Pfizer buscará luz verde para vacunar a niños menores de 5 años
La FDA espera aprobar las vacunas para niños pequeños a fines de febrero. Los datos sobre un régimen de tres dosis no se enviarían hasta fines de marzo
La FDA espera aprobar las vacunas para niños pequeños a fines de febrero. Los datos sobre un régimen de tres dosis no se enviarían hasta fines de marzo

El tratamiento de Pfizer, llamado Paxlovid, es una combinación de dos drogas -nirmatrelvir, una medicina experimental, y ritonavir, un antiviral que ya existe y que es usado contra el VIH
Sobre la eficacia de dos dosis, la respuesta del laboratorio fue muy tibia: "Probablemente no queda suficientemente neutralizada (la nueva variante) después de dos dosis". Sin embargo, la OMS tranquilizó a la población asegurando que las vacunas siguen siendo eficaces contra las complicaciones por el coronavirus
Pfizer firmó un acuerdo de licencia voluntaria que debe permitir el acceso a su píldora anticovid más allá de los países ricos, una vez que haya sido autorizada, y luchar así más eficazmente contra una pandemia que sigue causando estragos en todo el mundo

Otros laboratorios podrán recibir una licencia para fabricar la pastilla y distribuirla junto con el medicamento ritonavir, originalmente utilizado contra el virus del Sida. Esto beneficiará a 95 países

Las píldoras evitan la hospitalización y muerte en la mayoría de pacientes con el coronavirus Sars-CoV-2. Molnupiravir, de Merck, ya se usa en Reino Unido. Ahora llega Paxlovid, la propuesta de Pfizer

Unos 28 millones de niños de entre 5 y 11 años ya pueden recibir la vacuna contra el covid-19 de Pfizer-BioNTech en Estados Unidos, un nuevo paso en la campaña de vacunación que muchos padres esperaban con impaciencia.

A finales de octubre, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) aprobó Comirnaty para niños de 5 a 11 años, allanando el camino para una nueva e importante campaña de vacunación en el país
Antes de que comience la inoculación, un comité de expertos de los Centros para la Prevención y Control de Enfermedades (CDC) se reunirá la semana entrante para dar su opinión
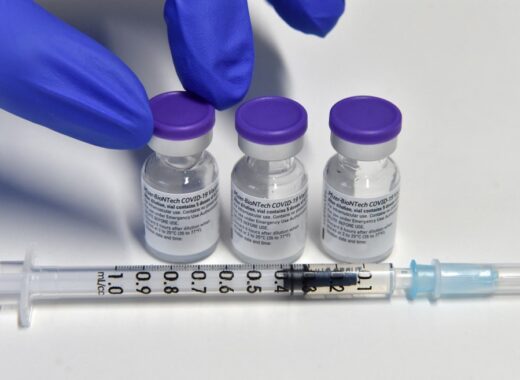
Un ensayo realizado en 10.000 personas de más de 16 años, muestra "una eficacia relativa de 95,6%" y "un perfil de seguridad favorable", según un comunicado de los dos laboratorios
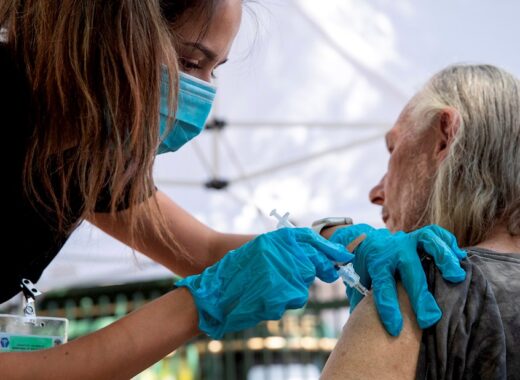
La autorización de la tercera dosis para estos grupos de personas llega una semana después de que lo recomendara un comité de asesores de la Administración de Alimentos y Medicamentos
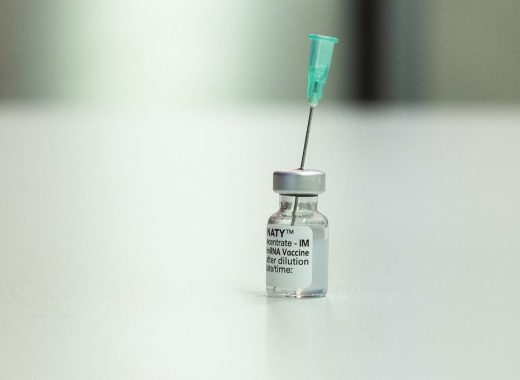
Una dosis de refuerzo también sea "probablemente sea necesaria" para las personas que han recibido una sola inyección de la vacuna Johnson & Johnson. Sin embargo, esta se daría a partir de noviembre
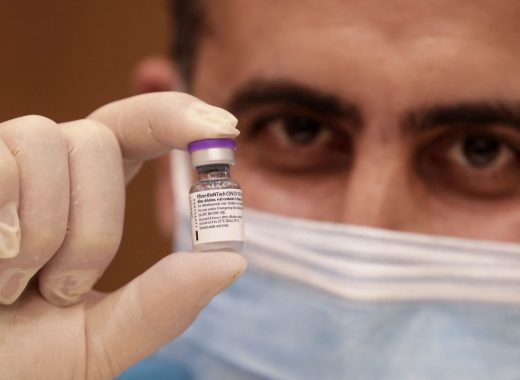
Es el tercer país de América y el noveno del mundo con mayor proporción de población inmunizada. Comenzó en enero, inmunizando a su personal médico y a la población mayor de 60 años. Todas las vacunas son de Pfizer

La vacuna de BioNTech/Pfizer se basa en la tecnología ARNm y fue la primera vacuna contra el covid-19 aprobada en los países occidentales a finales del año pasado

El siguiente envío de la vacuna de Pfizer será de 50.000 dosis, con lo que iniciará un proceso de entregas periódicas que sumarán 1.4 millones entre este miércoles y el 31 de enero. México se convirtió así en el primer país latinoamericano en recibir vacunas contra el covid-19, que se ha cobrado casi 120.000 vidas en esta nación de 129 millones de habitantes. El país es el cuarto más enlutado en cifras absolutas y el decimocuarto por tasa de mortalidad.
La validación por un comité de revisión compuesto por científicos independientes de Pfizer y de la FDA es una confirmación suplementaria de los resultados de los ensayos. Este representa el más alto nivel de validación científica
La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA), organismo independiente británico que la semana pasada se convirtió en el primero del mundo en autorizar esta vacuna, advierte ahora que "las personas con un historial significativo de reacciones alérgicas no la reciban" todavía.

Operation Warp Speed (OWS), "Operación a la Velocidad de la Luz", es el poco conocido nombre de la millonaria y exitosa estrategia que lanzara Donald Trump, con fuerte participación de militares, para alcanzar la vacuna contra el nuevo coronavirus que provoca la covid-19. Un proceso de investigación y desarrollo que normalmente dura unos 10 años, fue reducido a menos de uno, en medio de fuertes presiones.

La decisión de autorizar o no la vacuna dependerá de los científicos de la FDA y podría tomarse en la primera quincena de diciembre
La solicitud se formalizó ante la FDA esta tarde y se espera que la aprobación se priorice y se confirme en diciembre, con las primeras de las dos dosis que requiere la vacuna disponibles entre mediados y finales de ese mes