Responsables del servicio de sanidad pública británico advirtieron el miércoles de que las personas con un historial de reacciones alérgicas significativas no deberían recibir de momento la vacuna contra el covid-19 desarrollada por Pfizer/BioNTech.
La advertencia se produjo después de que dos trabajadores del Servicio Nacional de Salud (NHS) británico, que estuvieron entre los primeros en recibir la vacuna el martes, sufrieran reacciones alérgicas y necesitaran tratamiento.
El director médico del NHS en Inglaterra, Stephen Powis, explicó que ambas personas, que tenían un historial de alergias, se estaban recuperando correctamente.
La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA), organismo independiente británico que la semana pasada se convirtió en el primero del mundo en autorizar esta vacuna, ha aconsejado ahora que «las personas con un historial significativo de reacciones alérgicas no la reciban» como precaución, añadió.
Las reacciones alérgicas «significativas» incluyen medicamentos, alimentos o vacunas, según la MHRA.
El martes, miles de habitantes del Reino Unido se convirtieron en los primeros del mundo occidental en recibir una vacuna contra el covid-19, cuando el NHS comenzó la mayor campaña de vacunación desde su creación en 1948.
Reino Unido, con 62.033 muertos (y 1.750.241 casos) es el país de Europa más duramente golpeado por la pandemia, que ha paralizado la economía a niveles históricos.
Prioridades
La vacuna de Pfizer/BioNTech se administra en dos dosis, con 21 días de diferencia.
Las personas mayores de 80 años, sus cuidadores y el personal sanitario son los primeros designados para ser vacunados.
El país ha recibido unas 800.000 dosis de la vacuna en el primer lote de un pedido total de 40 millones que debe ir llegando progresivamente en los próximos meses.
El director ejecutivo de Pfizer, Albert Bourla, dijo el martes que entendía la inquietud internacional por la velocidad con la que las compañías farmacéuticas han producido vacunas contra el coronavirus. Pero insistió en que se respetaron todos los protocolos de seguridad.
Pfizer afirmó que el MHRA les había informado de las reacciones alérgicas, pero que durante los ensayos clínicos de fase 3 en más de 40.000 personas, la vacuna fue «generalmente bien tolerada, sin que se hayan registrado problemas de seguridad graves».
Primero de occidente
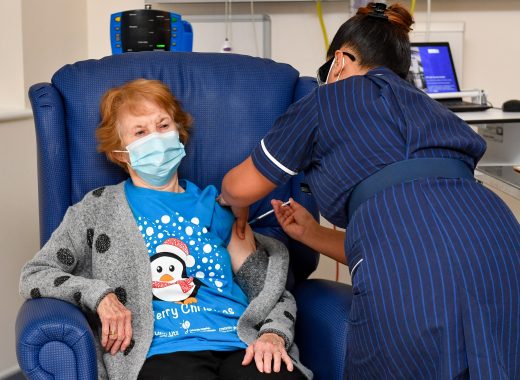
El Reino Unido se convirtió el martes en el primer país de occidente en vacunar contra el covid-19 de forma masiva a su población. El momento, anhelado e «histórico», se tradujo en una imagen: Margaret Keenan, una anciana de 90 años, sentada en un sillón con el brazo extendido, conversando tranquilamente con una enfermera en un hospital de Coventry, en el centro de Inglaterra.
«Me siento muy privilegiada por ser la primera persona en ser vacunada contra el covid-19, es el mejor regalo de cumpleaños por anticipado que hubiera podido esperar», declaró Keenan ante los fotógrafos, una semana antes de celebrar sus 91 años.
La mujer fue la primera paciente del mundo en recibir la vacuna de los laboratorios estadounidense Pfizer y alemán BioNTech en el país más enlutado de Europa, con 62.000 muertos.
La vacuna de Pfizer-BioNTech es una de las varias que dan esperanza de poner fin a una pandemia que ha matado a más de 1,5 millones de personas en todo el mundo y devastado economías.
Estudios desde EEUU
Los expertos de la agencia de medicamentos de Estados Unidos (FDA) consideraron en un informe publicado este martes que la vacuna contra el covid-19 de los laboratorios Pfizer y BioNTech no presenta riesgos de seguridad que impidan su autorización.
Los datos de seguridad de 38.000 de los participantes en el ensayo clínico, con un seguimiento medio de dos meses después de la segunda dosis, «sugieren un perfil de seguridad favorable, sin identificación de problemas de seguridad específicos que impidan» la autorización, escribieron los expertos.
La agencia reguladora estadounidense tiene previsto dar a conocer su decisión sobre la vacuna, autorizada en Reino Unido y otros países, tras una reunión de su comité consultivo el jueves.
Los efectos secundarios más frecuentes entre los 43.252 participantes en el ensayo clínico, incluidos niños y adolescentes de 12 años o más fueron: reacciones alrededor del lugar de la inyección en el brazo (84,1%), cansancio (62,9%), dolores de cabeza (55,1%), agujetas (38,3%), escalofríos (31,9%), dolores en las articulaciones (23,6%) y fiebre (14,2%).
Se registraron reacciones fuertes entre el 0 y el 4,6% de los participantes, y éstas fueron menos frecuentes en las personas mayores de 55 años (2,8%) que en los jóvenes (4,6%).